呼吸道合胞病毒(RSV)疫苗是新冠疫情之后,全球创新疫苗研发领域竞争最激烈的产品。因其拥有百亿美元级别的蓝海市场空间,全球已有数十家疫苗研发企业布局,其中包括14家中国企业。苏州艾棣维欣生物的ADV110是目前我国企业中RSV疫苗研发进展最快的产品。近日,艾棣维欣在《medRxiv》发表了II期临床数据的论文,临床结果显示ADV110疫苗具有良好的安全性、耐受性和免疫原性,这标志着该产品在临床研发方面取得了积极进展,进度跻身国际最前列,也进一步推动了国内RSV疫苗领域的开发进程。

呼吸道合胞病毒感染现状
呼吸道合胞病毒(RSV)是一种导致呼吸系统疾病的主要病原体,可引发各年龄段人群的下呼吸道感染(LRTI),对于婴幼儿、老人及患有基础性疾病人群来讲, RSV病毒的威胁可认为是致命的。RSV感染是全世界五岁以下儿童住院和死亡的主要原因。据《柳叶刀》估计,2019年全球5岁以下儿童中约有3,300万RSV-ALRTI(RSV病毒感染伴随急性下呼吸道感染症状)病例,并导致其中约360万儿童住院以及10万儿童死亡。根据灼识咨询预计,2032年全球5岁以下儿童RSV严重感染发病人数将达到3,707万人,其中中国儿童病例约有290万人,2022年至2032年全球5岁以下儿童RSV严重感染发病人数复合年增长率预计为1.1%。即使在症状轻微的儿童中,未经治疗的RSV感染也可能发展成慢性呼吸道疾病,如喘息和哮喘,并影响儿童长久的生长发育。对于老年人,RSV病毒感染会引起或加重慢性阻塞性肺疾病(COPD)、慢性心力衰竭等疾病,导致了相当数量患者住院治疗、重症甚至死亡,带来极大的负担。RSV感染导致疾病的情况在新冠疫情之后更为明显。
疫苗开发行业格局
RSV是迫切需要疫苗保护来对抗的传染性疾病,其疫苗存在巨大的蓝海市场空间。预计到2032年,RSV药物整体全球市场(包括治疗药物及预防疫苗)将增至128亿美元,中国RSV药物市场将增至15亿美元,其中疫苗预计占到一半以上。但是,RSV疫苗的研发之路已逾60年,其开发历程坎坷。早年研发的RSV灭活疫苗出现过儿童受试者在感染RSV病毒后发生了严重的肺部炎症损伤甚至两例死亡的事件,如今这种问题被称为VED(vaccine-enhanced disease)或ERD(enhanced respiratory disease)。在灭活疫苗后,也相继出现了其他技术路线的RSV疫苗,主要包括减毒活疫苗、重组蛋白亚单位疫苗、病毒载体疫苗、核酸疫苗等。但历史上的RSV疫苗临床试验均以失败告终,原因主要表现在安全性问题和保护力不足。近两年的临床研发失败案例包括,杨森制药开发的病毒载体RSV疫苗于2022年宣布II期临床终止、Bavarian Nordic的病毒载体RSV疫苗于2023年宣布III期研究中未能显著降低下呼吸道疾病(LRTD)的发生率,因此决定终止该产品的开发计划。
直到2023年5月,RSV疫苗的研发终迎来了曙光。葛兰素史克(GSK)公司宣布旗下应用重组蛋白及新佐剂疫苗技术开发的呼吸道合胞病毒(RSV)疫苗 Arexvy 获美国FDA批准上市,用于预防 60 岁及以上人群由 RSV 引起的下呼吸道疾病,成为全球首款获批的RSV疫苗。FDA要求GSK进一步研究评估该RSV疫苗与急性播散性脑脊髓炎(ADEM)和格林-巴利综合征的风险,GSK还表示将评估该疫苗与房颤的风险。这个成果虽然不完美,但让我们看到这一领域实现零突破的希望。
随后2023年6月,辉瑞(Pfizer)公司宣布其开发的RSV重组蛋白疫苗 Abrysvo获美国FDA批准上市,用于预防60岁及以上成人由RSV引起的急性呼吸道疾病和下呼吸道疾病。2023年8月,该款疫苗经FDA批准通过对孕龄32至36周的孕妇进行主动免疫,预防出生至6个月大的婴儿因呼吸道合胞病毒引起的下呼吸道疾病(LRTD)和严重下呼吸道疾病。
在2023年7月,Moderna向欧洲药品管理局、瑞士药品管理局和澳大利亚药品管理局提交了mRNA技术开发的RSV疫苗mRNA-1345的上市许可申请,并开始向美国FDA滚动递交mRNA-1345的生物制品许可申请,预计最快将于2024年第二季度获批。

根据国际卫生组织PATH于2023年9月更新的全球RSV疫苗与抗体药物研发概览图,紧随其后的项目包括中国艾棣维欣生物、日本第一三共、美国Icosavax的三款重组蛋白疫苗,以及法国赛诺菲和美国Meissa开发的减毒活疫苗。
在国内,已有十四家企业布局RSV的候选疫苗。其中,处于临床阶段的为艾棣维欣,其他疫苗企业如智飞生物、沃森生物/蓝鹊生物、石药集团等,处于临床前研究阶段。
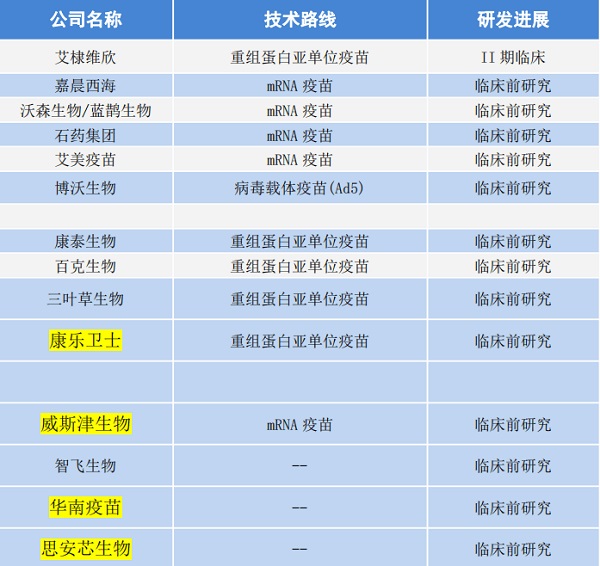
表:国内RSV疫苗研发现状
艾棣维欣RSV疫苗ADV110
艾棣维欣在2023年5月份曾在学术期刊《Vaccines》上发表RSV疫苗ADV110的I期临床数据。研究论文显示,在18-45岁的健康成年人中,ADV110疫苗具有良好的安全性、耐受性和免疫原性。

本次ADV110的II期临床试验是在澳大利亚进行的一项随机双盲、安慰剂对照、剂量探索临床试验,受试者为60-80岁的健康老人,旨在评估疫苗的安全性、耐受性及免疫原性,进而在I期临床试验的基础上积累更多受试人群的安全性和免疫原性数据,并评估后续临床研究的剂量,其临床方案如下图所示。

试验分为三组进行,低剂量和高剂量两次免疫组,以及高剂量加强免疫组。该试验共有125名临床受试参与者进入试验列队,其中124名参与者(99.2%)完成所有给药计划,125名参与者(100%)全部完成最后一次给药四周后的随访。安全性数据显示,不同剂量的ADV110疫苗均具有良好的安全性和耐受性,所有组在试验中均没有SAE发生,TRAE的发生率没有随疫苗剂量或频率的增加而升高。在免疫原性评估中,数据显示在接种ADV110疫苗后,与免疫前的基线水平相比,所有组的抗原特异性抗体几何平均浓度(GMC)都有所增加,且各组反应率均超过80%。相对于低剂量ADV110(10μg)两次免疫组,给予高剂量ADV110(20μg)两次免疫组,可在后续观察期持续产生抗体,表现出更强的免疫反应,且统计学显著。额外第三次免疫加强会诱导抗体水平进一步增加,在所有观察时间点抗体产生水平均显著高于初始基线测量值。数据证明了ADV110从低剂量到高剂量队列与剂量相关的抗体增强特性,多次免疫在抗体应答中也呈现出重要作用,显示了良好的免疫原性与量效关系。
据论文介绍,RSV疫苗ADV110的设计初衷是产品既能具有良好的免疫原性且同时能够抑制与VED风险相关的过度的T细胞反应。避免VED风险是用于儿童预防性RSV疫苗的一个决定性因素,根据已有数据,艾棣维欣的ADV110具备开发为一款优秀的老年人和儿童RSV疫苗的潜力。采用重组蛋白与新佐剂技术的ADV110,其研发进度现已跻身国际最前列,成为中国RSV疫苗领域与跨国企业竞争的明星选手。





















