新药研发通常花费大量时间和金钱:将一款新药推向市场需要10多年时间,近年来药物研发的成本激增,一项最新发表在Drug Discovery Today杂志上的分析显示,制药巨头平均每款新药的成本已达61.6亿美元[1]。时间、金钱的浪花,总是随潮汐散去,制药公司在研发方面的大量投资,可能并不会带来相应的回报。
如何避免这种投资回报不成正比的情况?整个医药行业正在探索可行的方案:1)借助人工智能(AI),向以数据为中心的药物发现转变;2)商业化模式转变,更倾向外部合作,布局多样化管线;3)开发新的modality,如大分子、细胞基因疗法等[2]。
AI正在缓缓蓄势,直至垂直渗透到药物研发的所有缝隙中。身在其中的你我,都正亲历科技的跃迁。
前沿技术方面,2021年,在第14届蛋白质结构预测大赛(CASP14)中,AlphaFold2以绝对优势斩获第一[3],表现出了预测蛋白质结构的强大能力,彻底点燃了AI药物研发的火苗。
2022年底,OpenAI发布ChatGPT,谷歌紧随其后,推出Bard大模型。硅谷大厂剑拔弩张,国内也不甘示弱。一个月内,阿里推出通义千问,百度推出文心一言,华为大模型叫做盘古,昆仑万维大模型叫天工。混沌初开,AI始生。
没有警示鸣笛,没有刹车声,蛋白结构预测和生成式AI像两辆并驾齐驱的马车,向时代冲撞而来。
产业方面,MNC纷纷布局AI制药,投资和交易金额不断攀升,AI制药赛道不断吸金。2015-2021的6年时间里,AI制药融资金额增加了近20倍(3.86亿美元vs 75.04亿美元),其中2021年融资金额相比上年翻了两番(10.82亿美元 vs 44.43亿美元)。即使在行业遭遇寒冬的2022年,AI制药赛道的融资事件仍较上年有所增长。
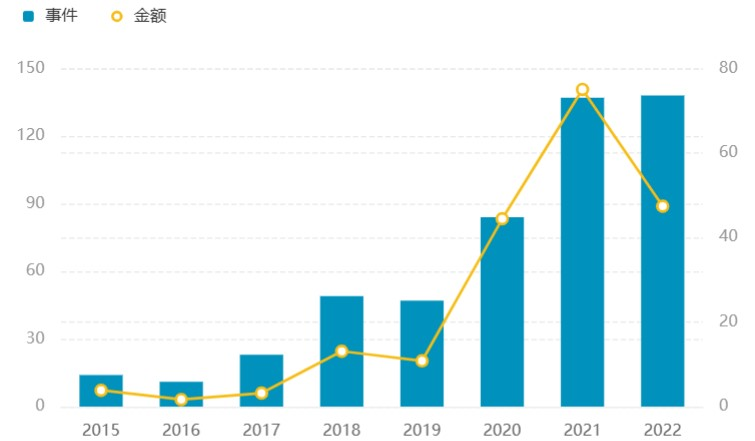
AI制药赛道融资趋势(金额单位:亿美元;数据截至2023-08-28;来源:医药魔方MedAlpha数据库)
AI制药赛道的医药交易迸发于2019年,次年交易总金额即突破40亿美元,2021年交易总金额相较上年同样翻了两番。资本浪潮动荡起伏,唯一不变的是对创新科技的追逐。

AI制药赛道医药交易趋势(数据截至2023-08-28,来源:医药魔方NextPharma数据库)
事实上,经过过去10年左右的发展,AI在药物研发中的应用已经十分广泛。从研发环节来看,AI不仅可以用于靶点发现、分子设计等临床前过程,还可以在临床试验阶段提高效率和准确性,缩短试验周期;从药物类型来看,AI已从传统的小分子药物扩展到了大分子、细胞疗法、基因疗法、核酸药物等领域。
随着蛋白结构预测等技术的飞速发展,AI+大分子药物开发变得越来越成熟,越来越多的公司加入这一赛道,其中就包括以独特的“构象选择机制”作为药物靶点理论的菲鹏数辉。
三驾马车,驶向AI制药未来
人类诞生之前,真理就已存在。它存在于木头摩擦的火星、树上掉落的苹果、水壶喷射的蒸汽,亦存在于翻译折叠的蛋白质。
1894年,德国化学家Emil Fischer提出锁钥模型(lock and key model),认为酶和底物在其结合部位的结构应当严格匹配,犹如一把锁与其原装钥匙在结构上匹配;1958年,Daniel E. Koshland将上述理论修正,提出诱导契合学说(induced fit),认为酶的活性部位具有一定的柔性,其构象可能在底物的诱导下发生变化,实现最大程度的契合。
但上述两种理论的前提是,蛋白质结构和构象是单一稳定的。实际情况却是,蛋白质具有活性和非活性构象。科学的魅力在于,它总是在不断迭代中,让大众更加接近真理。
1998年,马步勇博士结束了美国佐治亚大学的博士后生涯,成为美国国家癌症研究所(NIH)研究员。在对蛋白质动态构象与功能调控进行深入研究后,他总结提出了生物分子识别的构象选择(conformational selection)理论,由此建立了底物结合领域的锁钥模型、诱导契合学说和构象选择三大理论。
“构象选择机制”药物靶点理论是指基于对药物靶点和药物构象变化的深入理解和分析,结合生物活性调节,来实现药物的设计和优化。该理论具有普适性,对小分子药物(如变构药物)、大分子抗体药物和核酸药物设计均有指导作用,是从基于结构的药物设计到基于动态构象的药物设计的重大转变。马步勇博士现任上海交通大学药学院教授,同时也是菲鹏数辉的创始人兼首席科学家。
分子模拟技术基于计算机模拟的方法计算分子的物理、化学和生物学属性,可直接获得分子的构象(三维结构)、能量、动力学和相互作用模式,直接解释药物与蛋白质的相互作用、化学反应的机理、蛋白质折叠的特性等问题。
AI技术则可以通过分析生物分子的大量数据,预测一系列分子的性质和特征,改造或生成分子,加速药物研发进程。
分子模拟+AI的技术解决方案涵盖了包括药物受体和配体的动态构象选择,生物药物的双重变构效应,抗体类药物设计及优化,高效的多肽分子构象选择的调控与设计等一系列人工智能设计与预测。
工欲善其事,必先利其器。菲鹏数辉的科研团队将分子模拟技术与AI技术相结合,利用现代高性能计算机强大的计算能力,精确计算靶点蛋白/药物分子的构象变化和物理化学作用;通过蛋白质大数据采集、人工智能、分子模拟,准确把握原子-分子-功能域的动态和关联,实现了药物受体和配体的动态构象选择、生物药物的双重变构、抗体类药物设计及优化、高效的多肽分子构象选择的调控与设计等一系列AI药物设计及预测功能。
当“构象选择理论”的优势理念与“分子模拟+AI”的优势技术相碰撞,擦出炽热的火花,照亮了菲鹏数辉的四大技术平台:
1. 蛋白酶设计平台:利用深度学习模型,从复杂的多维氨基酸序列空间中学习蛋白质序列的进化关系,突破传统药物设计的化学空间限制,为下游提供具有自然物理特性、高度多样性、且符合管线筛选条件的序列变体。
2. 虚拟抗体筛选平台:利用AI+分子模拟训练的深度学习模型,实现抗体结构预测、抗体亲和力评估、抗体热稳定性/成药性/特异性评估与优化等功能。
3. 蛋白质工程平台:将已有的蛋白质稳定性数据和补充的分子动力学模拟数据,用于蛋白质稳定性预测与优化、热稳定性预测等模块。
4. 新型药物及小分子平台:利用AI+分子模拟,生成基于多动态构象靶点口袋的新型小分子。可用于小分子药物设计,如PROTAC、分子胶等。
有了先进理论、技术、平台的“三驾马车”,菲鹏数辉以自研计算平台为研发核心,逐步建立面向大分子和小分子的药物功能的设计模块,涵盖药物靶点发现、生化药物分子筛选、蛋白质和核酸工程、药物安全性预测等方面。
公司致力于打造AI分子设计技术领先的技术团队,成为药物研发问题解决者,并在未来建立领先的AI for Science研发模式,形成AI制药的成熟研发运营模式。科学总会推开历史那扇虚掩的大门,以自身的光芒照彻万古长夜。菲鹏数辉要做的,大概就是在这等待的过程中,蓄力成长,成为灿烂群星中的一员。
单丝不成线,独木不成林。作为菲鹏集团旗下子公司,菲鹏数辉也担负了为集团诊疗一体化赋能的责任。菲鹏数辉与菲鹏集团内部管线(制药、诊疗等部门)深度合作,承接内部需求,将AI+分子模拟应用于内部管线,同时进行AI产品在管线上的打磨与迭代,以在集团内部建立干湿结合、算法、分子模拟及湿实验结合的一体化计算辅助药物/试剂解决方案。
道阻且长,行则将至
任何事物的发展都要经历一个曲折的过程,AI制药从萌芽破土,到成长为参天大树,必然要面临狂风暴雨般的挑战。
一方面,数据质量和数量仍是限速步骤和壁垒。数据是AI模型的基础,然而药物开发中的许多数据来源不一,往往存在噪音、缺失和不一致,影响模型的可靠性和准确性。对于新靶点和新分子而言,药物研发中的数据往往是有限的,这也限制了AI模型的开发。
另一方面,模型适用的边界(解释性和泛化能力)以及与湿实验的配合仍需探索。AI模型在药物研发中能解决什么样的问题、更擅长解决哪一类问题、同一模型在其他靶点/分子上的适用性等问题仍然需要更多探索。从药物研发流程来看,AI优化的部分占比较少,并未打破传统制药的研发体系。
对于上述挑战,菲鹏数辉一方面通过结合分子、模拟的方法,可以弥补了部分数据缺失的情况;另一方面依据菲鹏集团在实验能力上的优势,不断探索AI制药在制药研发体系中新的使用场景,可以在获取自身发展同时,帮助探索行业新的边界。
有人认为AI制药已过融资风口,加上经济因素,生物制药投资趋向更为谨慎务实,注重落地场景和商业化前景。但ChatGPT等大语言模型为AI的落地应用提供了激励,催生相关技术的投入。
如何在苍茫大地中主导沉浮?菲鹏数辉表示,公司将会继续聚焦技术,跟进行业技术发展,探索分子动力学与AI的融合技术路径,形成技术的差异化;并紧密结合下游实验和制药管线,打磨有效靠谱的药物计算工具。
未来以大模型为基础的下游AI制药应用会层出不穷,自然语言领域、图像领域、自动驾驶领域的新技术会被不断应用到大、小分子的药物研发中;AI制药会在产研结合、干湿实验结合中找到商业化突破口,通过计算得到真正超过传统药物设计的分子。
过去未去,未来已来。道阻且长,行则将至。纵有万般险阻,但只要行而不辍,AI制药终将未来可期。





















